Методы исследований в микробиологии. Микроскопия
Цель микроскопического метода исследований – обнаружение в исследуемом материале возбудителей инфекций и изучение их морфологических и тинкториальных свойств.
Морфологические свойства характеризуются формой и размером клеток, а тинкториальные свойства – отношением микроорганизмов к красителям.
Результаты микроскопических исследований носят ориентировочный характер – с их помощью нельзя идентифицировать конкретный микроорганизм, можно лишь сделать вывод о его наличии либо отсутствии, форме, отношении к разным методам окраски.
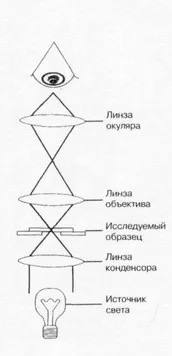
Устройство микроскопа
Микроскоп в своем составе имеет оптическую и механическую части.

Оптическая часть:
- Окуляр
- Объектив
- Конденсор
- Зеркало
Механическая часть:
- Тубус
- Револьвьер
- Тубусодержатель
- Штатив
- Корпус
- Макро- и микровинт
- Основание
- Предметный столик
У микроскопа есть несколько объективов, все они имеют разное увеличение. Чаще всего применяются объективы с увеличением в 10, 40 и 100 раз. Для микробиологических исследований применяют самое большое увеличение – в 1000 раз.
Виды микроскопии
Все методы микроскопических исследований делятся на две большие группы – оптическую и электронную микроскопию. В свою очередь, каждая из этих групп включает в себя различные техники исследований.
Оптическая микроскопия
К оптической микроскопии относятся:
- Световая микроскопия. Именно световая микроскопия применяется в рутинной диагностике инфекционных заболеваний. Практически всегда прежде чем посмотреть в окуляр, на предметное стекло наносят иммерсионное масло – оно необходимо для того, чтобы сосредоточить световой поток и лучше визуализировать объект.
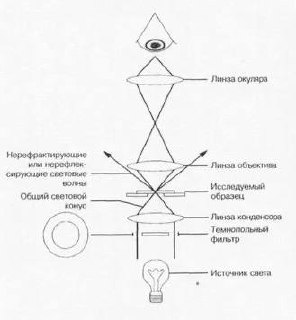
Световая микроскопия бывает светлопольной и темнопольной.
- Микроскопия в светлом поле. Свет проходит прямо через исследуемый препарат. Образуется светлое поле, на фоне которого видны микробные клетки.
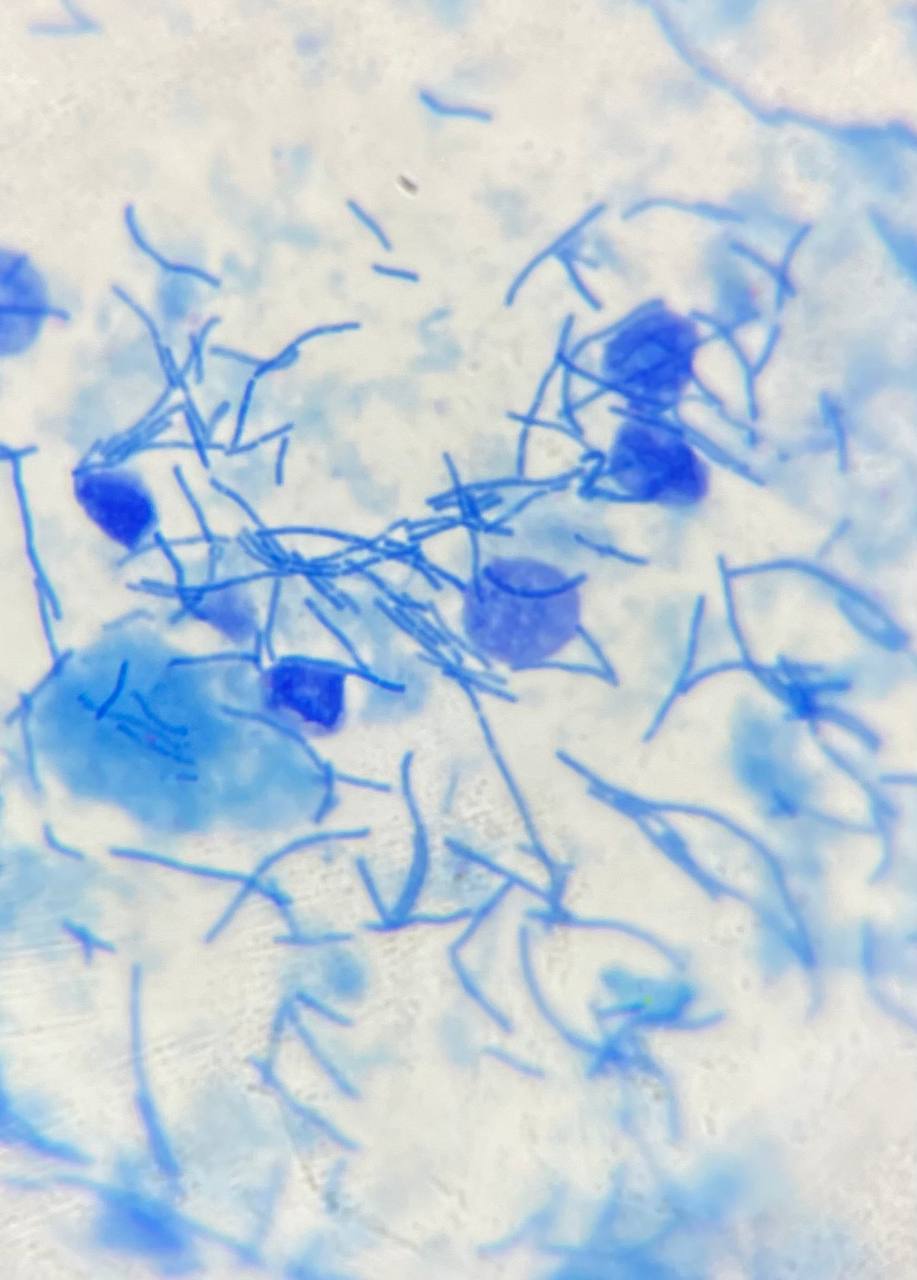
Перед микроскопией препарат необходимо зафиксировать и окрасить. Фиксация производится путём погружения в этиловый спирт либо в пламени горелки. При этом многие микроорганизмы могут погибнуть, что является существенным недостатком исследования.
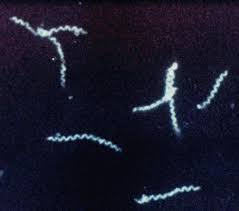
- Микроскопия в тёмном поле. Через препарат проходят не прямые световые лучи, а косые. Если в препарате присутствуют микроорганизмы, то они будут отражать свет и выглядеть как светящиеся объекты на тёмном поле.
В отличие от светлопольной микроскопии, препарат не требует предварительной фиксации, что даёт возможность наблюдать и оценивать подвижность микробов.
2. Фазово-контрастная микроскопия. Фазовый контраст
основан на явлении интерференции световых волн. Когда
две волны находятся в одной фазе, их амплитуды
складываются и усиливаются. Однако при различии фаз
на половину длины волны происходит полное гашение.
Использование интерференции позволяет увеличить
контрастность и изучать неокрашенные препараты.
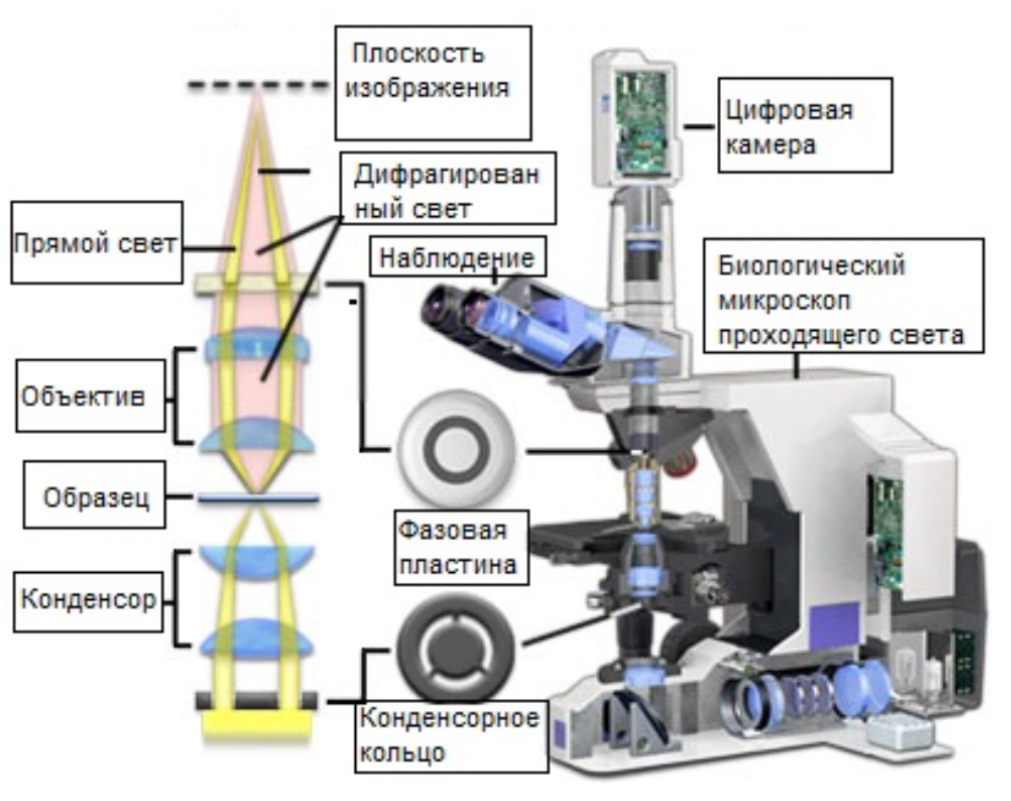
В оптический путь световой микроскопии вводятся два дополнительных элемента — обычный объектив заменяется на объектив с фазовой пластинкой, а в конденсор осветителя добавляется кольцевая диафрагма (конденсорное кольцо), в которой свет может пройти только через тонкое кольцо.
Свет, который не взаимодействует с препаратом, попадает на фазовую пластинку, смещаясь при этом на +1/4 длины волны. В то же время биологические объекты рассеивают свет таким образом, что он не достигает фазовой пластинки и смещает свою фазу на −1/4 длины волны. Это приводит к образованию разности в 1/2 длины волны в областях, где свет проходит через препарат, что вызывает взаимное гашение волн прямого и дифрагированного света и создает тёмные, контрастные зоны в изображении.
3. Люминесцентная (флюоресцентная) микроскопия.
Препарат предварительно окрашивают флуорофорами –
специальными красителями, которые начинают испускать
видимое излучение (начинают светиться) при воздействии
на них оптическим излучением определенного диапазона
(это явление называется флуоресценция).
Источник света во флуоресцентном микроскопе — яркая лампа. Свет от лампы проходит через светофильтр, который оставляет оптимальные для возбуждения флуоресцентной метки длины волн. Прошедший через светофильтр свет отражается и фокусируется объективом на образце, возбуждая флуоресценцию метки. Флуоресцентный свет от препарата через объектив попадает на второй светофильтр, который дополнительно отсекает фоновый свет от лампы.
Таким образом, в микроскоп можно наблюдать только свет от флуоресцентной метки, которая фиксирована на объектах поиска.
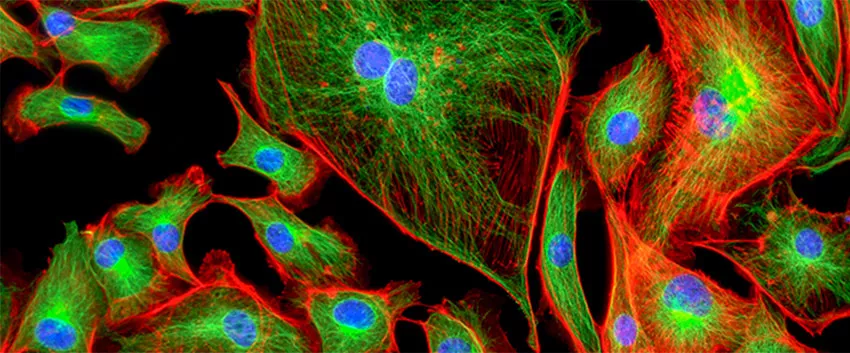
Иммунофлуоресцентная микроскопия – проводится с использованием антител. Бывает прямой и непрямой.
- Прямая иммунофлуоресценция: флуорофор связан со специфичными антителами, которые взаимодействуют со специфичными антигенами. Когда происходит взаимодействие антиген-антитело, флуорофор испускает вторичное свечение.
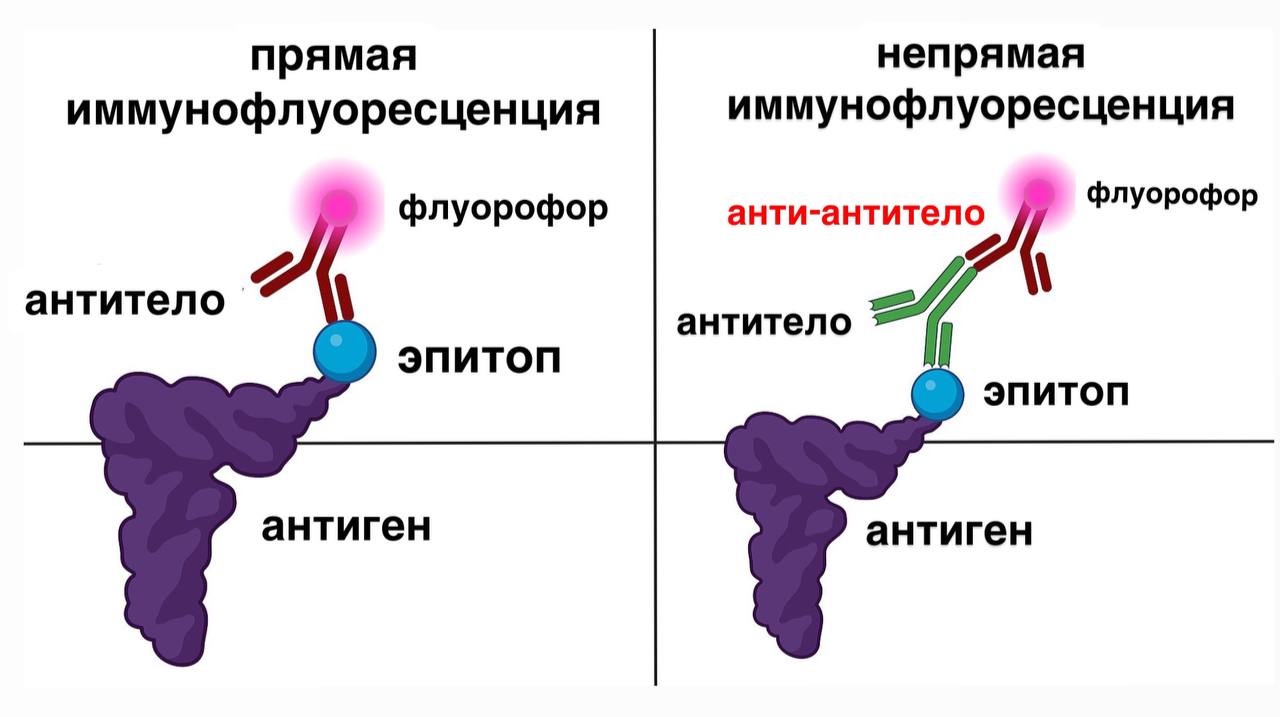
- Непрямая иммунофлуоресценция: аналогична прямой, но к иммунному комплексу антиген + антитело (без флуоресцентной метки) добавляются анти-антитела, меченые флуорофором.
Электронная микроскопия
В отличие от световой, электронная микроскопия практически не используется в рутинной практике и применяется, по большей части, в научно-исследовательских целях.
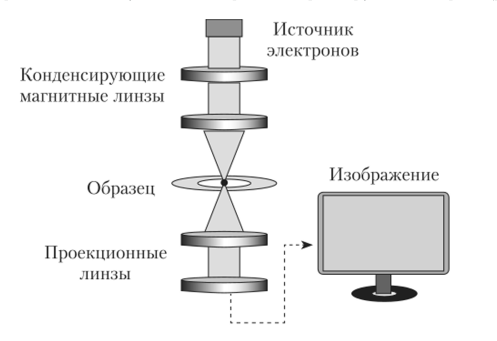
Основное отличие электронного микроскопа от оптического – источник излучения: если в оптическом микроскопе он представлен лампой, то в электронной это электронная пушка (вольфрамовая нить, нагреваемая электрическим током), из которой исходит поток электронов.
Выходящий из электронной пушки пучок электронов движется в вакууме под влиянием электромагнитного поля.
Конденсорная линза направляет пучок электронов на объект, а увеличивающие линзы создают увеличенное изображение, выводящееся на экран.
Преимущества и недостатки микроскопического метода
Преимущества:
- Простота исполнения
- Быстрое получение результатов (менее часа)
- Низкая стоимость исследования
Недостатки:
- Низкая чувствительность
- Низкая специфичность
- Без использования антител не применимо для микроорганизмов размерами менее 200 нм (вирусы)
- Как правило, не позволяют диффиренцировать живых микробов от мёртвых
- Не позволяют определить чувствительность к антимикробным препаратам
- Субъективность метода
А если хотите знать подробнее о тинкториальных свойствах микроорганизмов, переходите к нашему курсу.
Читайте также о гистологическом строении кожи.
Похожие статьи