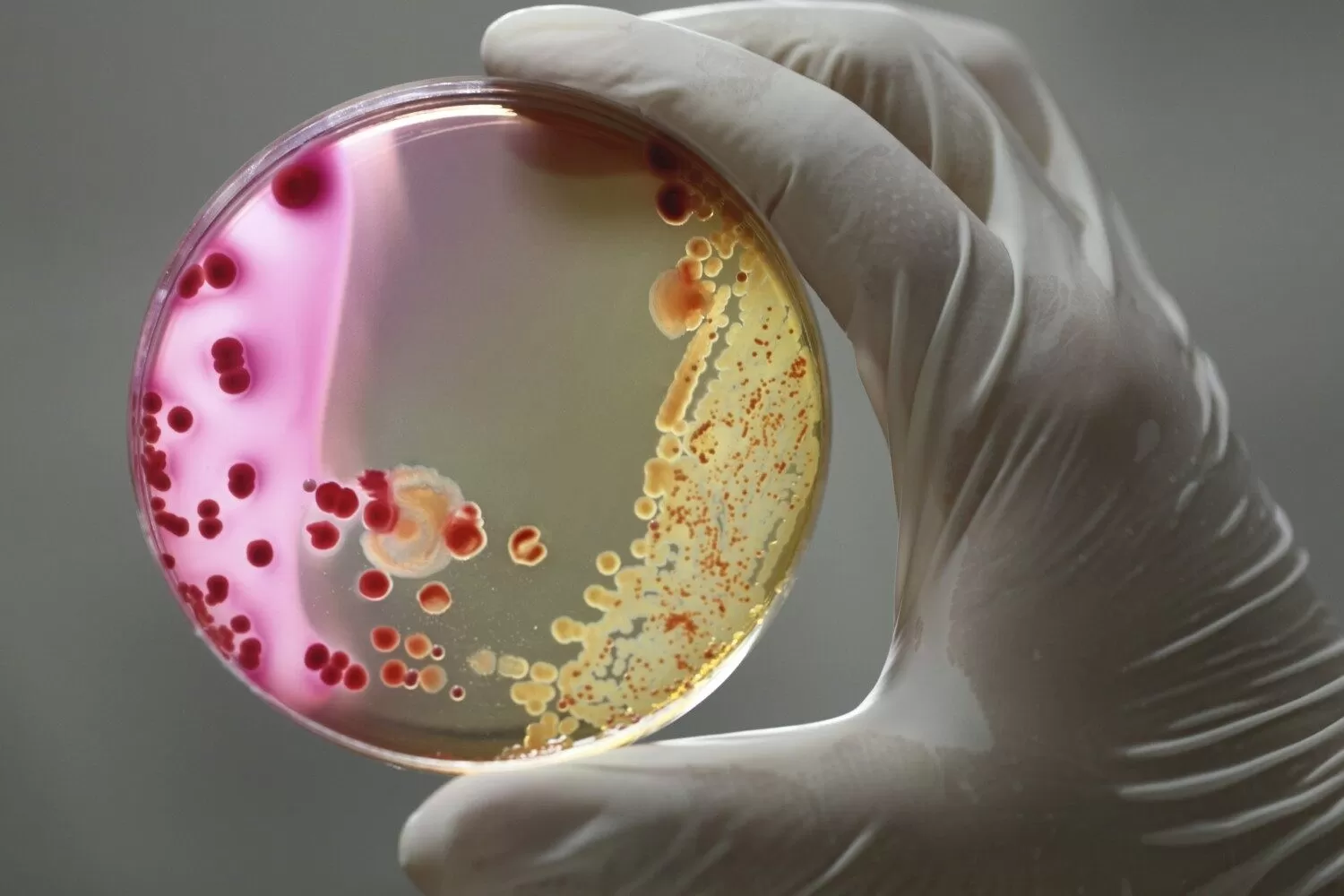
Методы исследований в микробиологии. Культуральный метод
Цель культуральных (бактериологических) исследований – выделить из биоматериала от пациента интересующий микроорганизм, получить бактериальные колонии и определить некоторые свойства (ферментативная активность, чувствительность к антибактериальным препаратам и т.п.)
Питательные среды и их классификация
Питательная среда - жидкий, полужидкий или плотный субстрат, используемый для выращивания микроорганизмов.
Типы питательных сред:
- Обогащённые – содержат питательные вещества, обеспечивающие рост многих микроорганизмов (в том числе некоторых труднокультивируемых)
- Селективные – обеспечивают рост определенных микроорганизмов, подавляя рост других
- Дифференциально-диагностические – позволяют выявлять определенные биохимические или другие фенотипические свойства микроорганизмов (используются в целях дифференцировки микробов)
- Среды общего назначения – используются для выявления широкого спектра возбудителей (мясо-пептонный агар (МПА), мясо-петонный бульон (МПБ))
По консистенции питательные среды делят на:
- Жидкие
- Плотные (1,5 - 3% агара)
- Полужидкие (0,3 - 0,7 % агара)
Агар - полисахарид сложного состава из морских водорослей.
По происхождению:
- Естественные
- Полусинтетические
- Синтетические
По назначению:
- Универсальные (простые), используемые для большинства микроорганизмов (мясо-пептонный бульон - МПБ, мясо-пептонный агар - МПА)
- Специальные - среды для микроорганизмов, не растущих на универсальных средах (среда Левенштейна-Йенсена для возбудителя туберкулеза)
Методика культурального исследования
1 этап: посев исследуемого материала на плотные и жидкие питательные среды с целью получения изолированных колоний.
Посевы помещают в термостат при t = 37 С.
Колония — это популяция микробных клеток одного вида, сформировавшаяся в результате деления одной микробной клетки в условиях культивирования на плотной питательной среде.
Методы получения изолированных колоний:
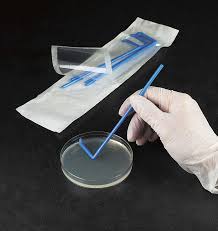
- Метод Дригальского: на поверхность застывшей среды в первую чашку вносят каплю исследуемого материала, содержащего микроорганизмы. Затем с помощью шпателя каплю растирают по всей поверхности среды. Этим же шпателем проводят по поверхности среды во второй и третьей чашках, в результате чего микробные клетки разделяются. После инкубации в первой чашке наблюдается рост в виде сплошного налёта. В следующих чашках количество становится меньше, и встречаются отдельно расположенные колонии.

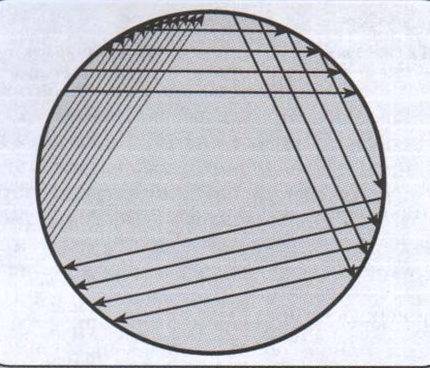
- Метод Голда (метод секторных посевов): материал помещают в сектор А чашки Петри, где осторожно распределяют, сделав несколько движений петлей по поверхности агара. Петлю стерилизуют обжиганием и проводят ею 4 раза по поверхности агара через сектор А в сектор 1. Петлю вновь обжигают и проводят 4 полосы через 1-й сектор во 2-й, затем аналогичным образом стерильной петлей из 2-го сектора в 3-й чашки Петри.
2 этап: изучают характер роста микроорганизмов на жидких и плотных питательных средах, из изученных колоний готовят мазок (окрашивают по Граму, микроскопируют).
Материал изолированных колоний пересевают на плотные питательные среды с целью получения чистой культуры микроорганизмов.
Посевы помещают в термостат при t = 37 0С.
Чистая культура - масса микроорганизмов, принадлежащих одному виду. Чистую культуру получают путём пересева на стерильную питательную среду клеток, взятых из изолированных колонии бактерий.
3 этап: определяют чистоту выделенной культуры микроорганизмов (из полученных посевов делают мазок, окрашивают по Граму, микроскопируют).
С выделенной чистой культурой определяют:
- Биохимическую активность
- Антигенную структуру
- Чувствительность микроорганизмов к антибактериальным препаратам.
- Определение биохимической активности (наличия у микроорганизма специфических ферментов) – «пестрый ряд»: берётся набор питательных сред, в каждой среде – определенный питательный субстрат. На каждую среду высеивают чистую культуру микроба, после чего наблюдают продукты утилизации субстрата, по наличию которых можно сделать вывод о присутствии у бактерии определенного фермента.

- Идентификация антигенной структуры (серотипирование). У каждого микроорганизма на поверхности клетки есть антигены, например: Н – жгутиковый антиген, К – капсульный, О – липополисахаридный.
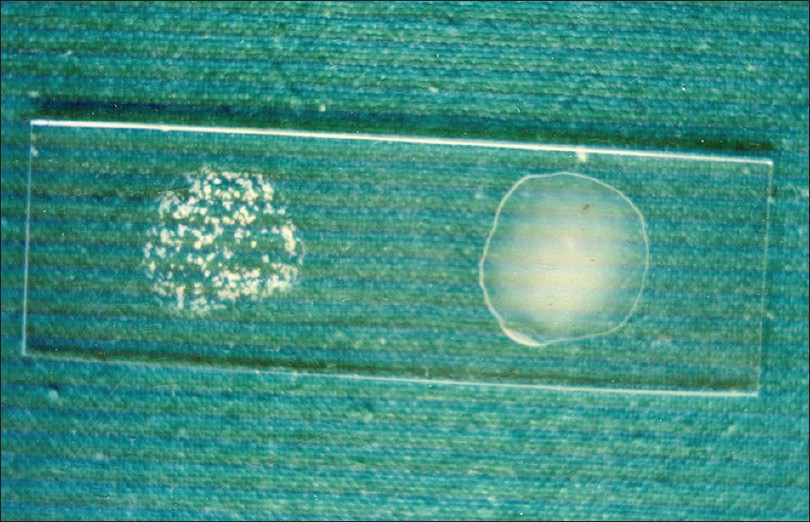
Чистая культура смешивается с сывороткой, содержащей известные антитела к искомым антигенам. Если данные антигены присутствуют на поверхности микробной клетки, то комплексы антиген-антитело будут выпадать в холопьеобразный осадок (агглютинировать)
Положительная реакция – образование хлопьевидного осадка.
Также в серологически реакциях можно идентифицировать наличие токсинов у микроорганизма – проводится реакция преципитации на токсинообразование: бактериальные культуры наносятся на питательную среду в чашке Петри. В центе чашки выбита лунка с антителами к токсину (антитела – в составе сыворотки). Так как антитела – водорастворимые соединения, они будут диффундировать через среду к антигенам токсина с последующим выпадением в осадок (осадок – это комплексы антиген-антитело). Таким образом, можно судить, токсигенный штамм это либо же нет.
Пример: определение токсигенности дифтерийной палочки – реакция преципитации по Оухтерлони.
Преимущества и недостатки культуральных методов:
Преимущества:
- Единственный способ определить концентрацию живых микроорганизмов в образце
- Наиболее надежный метод для определения чувствительности патогена к антибактериальным препаратам
- Средняя – высокая чувствительность
- Высокая специфичность
Недостатки:
- Не подходит для некультивируемых организмов
- Длительное время исследования (от 2 дней до 2 месяцев в зависимости от патогена)
- Высокие требования к транспортировке образцов (возбудитель не должен погибнуть при транспортировке, иначе роста не будет).
А если хотите ещё больше знать о питаельных средах, переходите к нашему курсу по общей микробиологии.
Читайте также о микроскопическом методе исследования.